
Please wait...

Please wait...
Corrales Monge Susana M. 1, Solórzano Herra Sandra 2
1Residente de Medicina Legal, Universidad de Costa Rica. Sección de Patología Forense, Departamento de Medicina Legal, Poder Judicial, Costa Rica.
2 Médica Forense, Universidad de Costa Rica. Jefa Sección de Clínica Médico Forense, Departamento de Medicina Legal, Poder Judicial, Costa Rica.
Correspondencia: Dra Susana Corrales Monge- sw23cm@gmail.com
Recibido: 07-10-2019 Aceptado: 07-I-2020
Resumen
El cáncer de mama es uno de los tipos más frecuentes de cáncer en la población femenina y presenta una
estrecha relación con la herencia genética. El asesoramiento genético procura informar y guiar a las
pacientes durante todo el proceso de identificación y diagnóstico de cáncer de mama hereditario. Por lo que
con el presente artículo se pretende demostrar la relevancia del asesoramiento genético en el abordaje de las
pacientes con cáncer de mama hereditario.
Se realizó una revisión sistemática de la literatura para la selección de publicaciones científicas que aporten
conocimiento sobre el cáncer de mama en relación con la herencia genética y otros documentos que
demuestren la importancia del asesoramiento genético en pacientes con cáncer de mama hereditario.
Con esta revisión, se obtuvo información valiosa sobre la importancia de la implementación del
asesoramiento genético, durante la realización de pruebas genéticas, en pacientes con cáncer de mama
hereditario.
Palabras claves
Cáncer, mama, genética, asesoramiento genético, pruebas genéticas
Fuente: DeCS (Descriptores en Ciencias de la Salud)
Abstract
Breast cancer is one of the most frequent types of cancer in the female population and has a close relationship
with genetic inheritance. Genetic counseling seeks to inform and guide patients throughout the process of
identification and diagnosis of hereditary breast cancer. Therefore, this article intends to demonstrate the
relevance of genetic counseling in the approach of patients with hereditary breast cancer.
It has been made a systematic review of the literature for the selection of scientific publications that provide
knowledge about breast cancer in relation to genetic inheritance and other documents demonstrating the
importance of genetic counseling in patients with hereditary breast cancer was performed.
With this review, valuable information was obtained on the importance of the implementation of genetic
counseling, during genetic testing, in patients with hereditary breast cancer.
Lianet Bermúdez Sánchez¹* , Maritza Canto Pérez² , Daniel Artiles Martínez¹ , Rubén Rodríguez Jiménez¹ , Dannis Durán Morales¹
¹Hospital Provincial Clínico Quirúrgico Universitario “Arnaldo Milián Castro”, Santa Clara, Villa Clara, Cuba
²Universidad de Ciencias Médicas de Villa Clara, Santa Clara, Villa Clara, Cuba
*Lianet Bermúdez Sánchez. lianetbs90@gmail.com
Recibido: 22/10/2020 – Aprobado: 26/11/2020
RESUMEN
Introducción: el diagnóstico precoz es un elemento clave en el manejo del cáncer bucal, de ahí la importancia de implementar métodos diagnósticos que sean sencillos, poco cruentos y fiables. En este sentido ha resurgido el interés por la citología oral, tanto para diagnosticar, como para monitorizar.
Objetivo: determinar la utilidad de la citología exfoliativa por cepillado como método para el diagnóstico precoz del cáncer bucal.
Métodos: se realizó un estudio descriptivo, transversal, cuanti-cualitativo, a doble ciegas, en el Servicio de Cirugía Maxilofacial del Hospital “Arnaldo Milián Castro” entre marzo de 2016 y octubre de 2017. La muestra quedó constituida por 33 pacientes que presentaron lesiones sospechosas de malignidad o premalignidad.
Resultados: predominaron el sexo masculino (63,6%) y el grupo etario de 60 a 69 años (33,3%). La toma de muestra citológica con cepillo dental fue indolora para el 45,5% de los pacientes; refirieron molestias leves el 54,5%. Existió una concordancia de 0,89 según el índice de Kappa entre la presencia de células neoplásicas detectadas a través de la citología y la biopsia, con un alto valor diagnóstico de la prueba, con valor predictivo positivo de 0,95 y valor predictivo negativo de 0,93. En cuanto al grado de diferenciación de los tumores malignos, la concordancia entre ambos métodos fue leve (0,094).
Conclusiones: la citología resultó ser un método útil para el diagnóstico de cáncer bucal, que ofreció concordancia con el diagnóstico histopatológico de manera predominante.
Palabras clave: cáncer bucal; medios diagnósticos; biopsia; citología exfoliativa
ABSTRACT
Introduction: the early diagnosis is a key factor in the management of an oral cancer, so, it is very important the implementation of simple, not harmful and liable diagnosis method. In this sense, the interest in oral cytology has increased for diagnosing and monitoring.
Objetive: to determine the usefulness of exfoliative cytology in the brushiness as a method for the early diagnosis in oral cancer.
Methos: a descriptive, cross-sectional, quanti-qualitative and double blind study was made in the Maxillofacial Surgery service from Arnaldo Milián Castro Hospital, between March 2016 and October 2017. The sample was set by 33 patients who had oral lesions with suspicion of malignancy or premalignancy.
Results: there was a predomination in the masculine sex (63,6%) and those whose ages were between 60 and 69 years (33,3%). The sample with dental brush was painless for the 45,5% of patients; while 54,5% of them referred slight discomfort. There was a concordance of 0,89 according to Kappa index between the presence of neoplastic cells that were detected trough cytology and biopsy with a high diagnostic value of test, with positive predictive value (0,95) and negative predictive value (0,93). According to the grade of differentiation of the malignant tumor, the concordance between both methods was slight (0,094).
Conclusions: the cytology was a useful method for the diagnosis of oral cancer, that showed a coincidence with the histopathological diagnosis in predomination way.
Key words: oral cancer; diagnosis method; biopsy; exfoliative cytology
INTRODUCCIÓN
La cavidad oral es, a menudo, asiento de lesiones premalignas y malignas. La metodología diagnóstica clásica presenta la biopsia como suplemento al diagnóstico clínico.(1)
A pesar de la confiabilidad que brinda la biopsia en el estudio del cáncer bucal es importante implementar otras metodologías que sean sencillas, poco cruentas y fiables y que permitan realizar un diagnóstico y un seguimiento satisfactorios en los pacientes con lesiones precancerosas y cancerosas orales. En este sentido ha resurgido, en los últimos tiempos, el interés por la citología oral en el precáncer y el cáncer oral, tanto como metodología diagnóstica como predictiva, y para la monitorización de los pacientes.(2)
La citología tiene sus orígenes en los estudios del Dr. George Nicholas Papanicolaou, que estudió citologías de pacientes con cáncer y observó que las células se exfoliaban y se podían estudiar mejor con coloraciones.(3) La citología exfoliativa oral se define como el estudio e interpretación de los caracteres de las células que se descaman, natural o artificialmente, de la mucosa oral.(4) En la mayoría de las enfermedades de la mucosa oral es posible el desprendimiento de las células, por lo que son fácilmente obtenibles por esta metodología.(5)
De acuerdo a los protocolos de manejo del cáncer oral, en Cuba se ha establecido la biopsia como medio diagnóstico, lo que permitirá una adecuada planificación del tratamiento. Algunos autores(6,7) han realizado esfuerzos por incorporar medios diagnósticos mundialmente estandarizados, como la citología exfoliativa.
En el Hospital “Arnaldo Milián Castro” se emplea únicamente la biopsia como medio diagnóstico de las lesiones de tejidos blandos de cavidad oral, lo que implica algunas complicaciones. En el orden institucional conlleva a la demora de la obtención del resultado histopatológico y en el área médica al retraso en la planificación del tratamiento, además de las molestias quirúrgicas que trae al paciente la toma de biopsia. A partir del precepto de que el estudio histopatológico no es sustituible en el diagnóstico del cáncer y el precáncer oral, se convino estudiar la citología exfoliativa por cepillado con el objetivo de determinar su utilidad como método para el diagnóstico precoz del cáncer bucal en el Servicio de Cirugía Maxilofacial del Hospital “Arnaldo Milián Castro”.
Esta investigación pretende determinar la utilidad de la citología exfoliativa por cepillado como método para el diagnóstico precoz del cáncer bucal.
MÉTODOS
Se realizó un estudio descriptivo, transversal, cuanti-cualitativo, a doble ciegas, en el Servicio de Cirugía Maxilofacial del Hospital Clínico Quirúrgico Universitario “Arnaldo Milián Castro” de la Ciudad de Santa Clara, Provincia de Villa Clara, en coordinación con el Servicio de Anatomía Patológica del mismo hospital, durante el período comprendido entre marzo de 2016 y octubre de 2017. La población estuvo constituida por 200 pacientes que acudieron a la Consulta de Cirugía Maxilofacial del Hospital durante el período de tiempo señalado por presentar enfermedades bucales. La muestra se conformó por 33 pacientes que presentaron lesiones sospechosas de malignidad o premalignidad y que necesitaban, como parte de su estudio preoperatorio, la toma de biopsia para establecer la conducta terapéutica. Para la selección de la muestra se empleó un muestreo no probabilístico intencional, teniendo en cuenta criterios de inclusión, exclusión y salida.
Criterios de inclusión:
Pacientes que dieron su consentimiento informado para la participación en el estudio
Pacientes que presentaron lesiones localizadas solamente en la mucosa de la cavidad bucal
Pacientes que presentaron lesiones que afecten la integridad de la mucosa oral, de manera tal que se produjera desprendimiento celular al cepillado
Pacientes que presentaron lesiones que, clínicamente, impresionaran ser premalignas o malignas
Pacientes que presentaron lesiones que necesitaban ser biopsiadas tanto de manera incisional como excerética.
Criterios de exclusión:
Pacientes a los que se les había realizado toma de biopsia incisional o excerética de la lesión en otra institución, de manera que la muestra no hubiese sido procesada en el Departamento de Anatomía Patológica del Hospital “Arnaldo Milián Castro”.
Criterios de salida:
Muestras que por el inadecuado procesamiento perdieron su identidad.
Los pacientes que conformaron la muestra objeto de estudio recibieron atención en la Consulta de Cirugía Maxilofacial del Hospital “Arnaldo Milián Castro”. Una vez detectada la lesión con sospecha de malignidad o premalignidad, se procedió a la toma de muestra a través de la citología exfoliativa.
Pasos para la toma de muestra a través de la citología exfoliativa:
1. El paciente se colocó reclinado en el sillón dental, en una posición cómoda, con adecuada iluminación, y se le explicó previamente el procedimiento al que se sometería
2. Se dispuso de un cepillo dental cuyas fibras fueran de dureza media, con una talla de la parte activa de 2,5cm de largo y 1cm de diámetro, dos láminas portaobjetos previamente enumeradas para identificar el caso y un frasco con alcohol al 95% para fijar la muestra
3. Para la toma de muestra se emplearon guantes de examen. Los tejidos fueron separados por el ayudante, mediante un espejo bucal, para un mejor acceso al campo
4. Previa asepsia de la cavidad oral mediante colutorio con clorhexidina acuosa al 2% se cepilló la lesión desde su porción distal a la proximal, con repetidos movimientos de arrastre, evitando los tejidos sanos y las zonas de necrosis central
5. La lámina portaobjetos, previamente individualizada, se dividió longitudinalmente por una línea imaginaria, por encima y por debajo de la que se esparcieron las células exfoliadas mediante la aplicación de las cerdas del cepillo contra la lámina. El procedimiento se repitió y se empleó una segunda lámina
6. Se introdujeron inmediatamente las láminas en el frasco con alcohol al 95% para su fijación
7. Se desechó el cepillo dental empleado en la toma de la muestra
8. Se envió la muestra al Departamento de Anatomía Patológica del Hospital “Arnaldo Milián Castro” para su procesamiento y análisis.
Posterior a la citología, se procedió a la toma de biopsia, ya fuera incisional o excisional, para lo que se empleó la sistemática habitual bajo anestesia local. La muestra de la biopsia se colocó en un frasco con formol al 10% y se envió al Departamento de Anatomía Patológica del Hospital “Arnaldo Milián Castro” para su procesamiento y análisis.
Puesto que la literatura recoge como principales factores de resultados falsos negativos la subjetividad de los Especialistas en Anatomía Patológica y la forma de tomar la muestra, para controlar los sesgos se garantizó que las muestras fueran tomadas siempre por el mismo operador y el estudio citológico realizado por el mismo Especialista. Además, no se reflejó el diagnóstico presuntivo en la solicitud de citología para evitar influenciar el dictamen citológico. Las láminas, tanto de citología como de biopsia, se incluyeron en el protocolo de conservación, durante el plazo de tiempo de cinco años, para posterior estudio en caso necesario.
Procesamiento y análisis de los datos
Para el procesamiento y el análisis de los datos se utilizó el Programa SPSS versión 20.0 para Windows y se emplearon frecuencias absolutas y relativas, prueba para determinar la asociación entre las variables como el coeficiente de correlación de Pearson y determinación de valores predictivos aplicando las siguientes fórmulas:

Tabla 1. Valores de los resultados de la citología y la biopsia

A: verdaderos positivos; B: falsos positivos; C: falsos negativos; D: verdaderos negativos
Los resultados se presentaron en forma de tablas para facilitar su análisis y su comprensión.
Para valorar la concordancia entre los dos métodos se utilizó la determinación del índice Kappa de Cohen. Se tuvieron como medidores los valores que se presentan (Tabla 2):
Tabla 2. Índice Kappa de Cohen

El valor diagnóstico de la prueba se determinó a través de los valores predictivos positivo y negativo, así como la sensibilidad y la especificidad.
Se aplicaron pruebas para la correlación de variables (Pearson).
Para la interpretación de los resultados en el coeficiente de correlación de Pearson se consideraron los valores de p:
Si p<0,05 la asociación es significativa
Si p≥0,05 no existe asociación con diferencia significativa.
Aspectos éticos
En todos los casos, para la inclusión de pacientes en la investigación, se contó con su consentimiento informado. Se incluyeron en el estudio solo los pacientes en los que fue estrictamente necesaria la toma de biopsia. La investigación fue conducida de acuerdo al código de Helsinki.
RESULTADOS
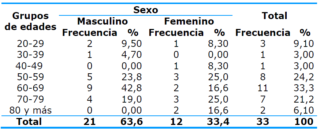
La Tabla 3 muestra la distribución de la muestra en cuanto al sexo y a los grupos de edades. Predominaron los pacientes del sexo masculino y con rangos de edades comprendidos entre 60 y 69 años.
Tabla 3. Distribución de la muestra en cuanto al sexo y a los grupos de edades
Durante la toma de muestra para la citología a 15 pacientes (45,5%) no le resultó dolorosa la toma de muestra mediante cepillado para estudio citológico; refirieron molestias leves 18 (54,5%).
El 92,9% de las lesiones con categoría de NCN (negativo de células neoplásicas) obtuvieron igual categoría en el resultado histopatológico de la citología, mientras que de 17 lesiones categorizadas como PCN (positivo de células neoplásicas) en 16 (94,1%) se halló concordancia a través de ambos métodos, con índice de Kappa muy bueno (0,89), con p<0,05. Las lesiones sospechosas de células neoplásicas (SCN) fueron tomadas como PCN para el análisis estadístico debido a que las lesiones SCN deben ser manejadas como PCN si no se cuenta con un diagnóstico concluyente. Se observó un alto valor diagnóstico de la prueba con valores predictivos positivos de 0,95 y valor predictivo negativo de 0,93 (Tabla 4).
Tabla 4. Concordancia entre la presencia de células neoplásicas detectadas a través de la citología y la biopsiaTabla 4. Concordancia entre la presencia de células neoplásicas detectadas a través de la citología y la biopsia
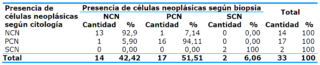
Kappa: 0,890; p<0,05; Sensibilidad: 95%; Especificidad: 93%; VPP: 0,95; VPN: 0,93
En la Tabla 5 se muestra que existió una correlación significativa al nivel 0,01 (bilateral) según la prueba de correlación de Pearson entre la presencia de células neoplásicas detectadas a través de la citología y la biopsia.
Tabla 5. Correlación entre la presencia de células neoplásicas detectadas a través de la citología y la biopsia

De las lesiones malignas 11 (68,7%) fueron clasificadas como bien diferenciadas a través del método histopatológico y coincidieron con el diagnóstico citológico. Se obtuvieron cuatro lesiones más con la clasificación de bien diferenciado a través de la citología, que no coincidieron con el resultado histopatológico, tres moderadamente diferenciado y uno poco diferenciado. La concordancia entre ambos métodos, en cuanto a diferenciación de la lesión, fue leve (0,094) según el índice Kappa, con p>0,282 (Tabla 6).
En la Tabla 7 se muestra el resultado de la aplicación del índice de correlación de Pearson. No se obtuvo una correlación significativa entre el resultado histológico y citológico para el grado de diferenciación en los tumores malignos.
Tabla 6. Concordancia entre el grado de diferenciación de la lesión detectado a través de la citología y la biopsia

Kappa: 0,094; p>0,282
Tabla 7. Correlación entre el grado de diferenciación de la lesión detectado a través de la citología y la biopsia

En cuanto a la correspondencia entre los diagnósticos histológico y citológico existe una coincidencia en 22 (63,6%) de los casos y no coincide en 11 (33,3%).
La Tabla 8 muestra las la presencia de células neoplásicas, según el resultado histológico, en los casos en los que no coincidieron la citología y la biopsia en cuanto al diagnóstico. El 90,9% de los casos en los que no existió tal coincidencia se trataba de lesiones benignas (NCN).
Tabla 8. Presencia de células neoplásicas, según biopsia, en las lesiones en las que no hubo correspondencia entre el diagnóstico citológico y el histopatológico

DISCUSIÓN
En el presente estudio la muestra estuvo constituida por 33 pacientes, según se muestra en la Tabla 3: predominaron los hombres con edades que oscilaron entre los 60 y los 69 años, lo que coincide con lo informado por otros autores.(1,8,9,10) Estadísticas similares se presentan en la literatura consultada, en la que se refiere que el cáncer de la cavidad oral representa el 3% de todos los tipos de cáncer en el mundo y que es el octavo más frecuente en hombres y el decimocuarto en mujeres,(10) probablemente asociado a la mayor incidencia de hábitos tóxicos en el sexo masculino, además de la presencia de factores hormonales protectores en la mujer.
La mayor incidencia y prevalencia en estos grupos etarios se corresponde, en parte, con el efecto acumulativo de los agentes carcinogénicos y a la disminución de la capacidad de respuesta de la mucosa bucal.
Es sabido que existe mayor prevalencia de cáncer bucal en adultos mayores. Esta es una razón importante por la que muchos autores plantean que la edad es el principal factor de riesgo en el desarrollo del cáncer bucal, pues la persona de mayor edad está más expuesta a diferentes factores que incrementan, de manera directa o indirecta, el riesgo de desarrollar un cáncer clínico, especialmente los hombres, en los que las tasas de incidencia son más altas, con un gradual aumento en el sexo femenino.(8)
Existe la interrogante sobre por qué se diagnostica un número mayor de pacientes con tumores malignos en estas edades si se cuenta con los conocimientos suficientes sobre la causa de muchos de estos. Una de las respuestas es que la aparición de un cáncer clínicamente diagnosticable se encuentra demasiado separada, temporalmente, de los estímulos o los factores que le dan origen para que pueda percibirse una relación causal entre ambos, lo que hace cada vez más difícil la educación sanitaria en este campo si se tiene en cuenta que los medios de comunicación masivos ofrecen información sobre el consumo de productos potencialmente carcinógenos. Por otra parte, los pacientes de mayor edad son diagnosticados en etapas más avanzadas de la enfermedad que los más jóvenes.(8)
De acuerdo con diferentes estudios realizados los pacientes diagnosticados de cáncer bucal en estadio I tienen una mejor supervivencia y calidad de vida al final del tratamiento (80% de las personas con tumores en etapas iniciales sobreviven por lo menos cinco años después del diagnóstico, mientras que de los casos detectados tardíamente solo sobrevive el 35% de los pacientes);(11) de ahí la importancia de un diagnóstico rápido y certero.
El diagnóstico histopatológico, que es el estándar dorado, tiene la desventaja de la tardanza en la emisión de un veredicto, mientras que a través de la citología, en el Departamento de Anatomía Patológica del Hospital “Arnaldo Milián Castro”, se puede obtener un diagnóstico en el plazo de tiempo de 24 horas. A pesar de que la literatura refiere que el diagnóstico citológico no debe tomarse como diagnóstico definitivo, los autores concuerdan en que puede ser empleado como referencia cuando se necesita un diagnóstico orientador en función de economizar el tiempo sin tratamiento y así evitar la progresión de la enfermedad.
El 45,5% de los pacientes refirió que no le resultó dolorosa la toma de muestra mediante cepillado para estudio citológico, mientras que el 54,5% sufrió de molestias leves, no clasificables como dolor.
La pérdida de la adhesión intercelular es el elemento que deviene en colaborador del desprendimiento de las células neoplásicas mediante el barrido con el cepillo dental. Este fenómeno permite que el arrastre mecánico de las cerdas del cepillo sobre la lesión no requiera demasiada mortificación de los tejidos y evita molestias al paciente. Estos datos resultan alentadores para el manejo de los pacientes aprehensivos que presentan lesiones sugestivas de malignidad y dadas sus características psicológicas no desean someterse a la toma de biopsia.(12)
De esta manera se contaría con un procedimiento para el diagnóstico que puede realizarse en breve tiempo en la consulta, sin necesidad de emplear agentes anestésicos, lo que además de generar las molestias correspondientes a la punción también encarece el proceso diagnóstico.
La Tabla 4 muestra la correspondencia entre la presencia de células neoplásicas detectadas a través de la citología y la biopsia; se toma como referencia fiable y estandarizada el resultado histopatológico. El 92,9% de las lesiones con categoría de NCN (negativo de células neoplásicas) según el resultado histopatológico obtuvieron igual categoría a través de la citología. De 17 lesiones categorizadas como PCN en 16 se halló coincidencia a través de ambos métodos, para un 94,1%. Al aplicar el índice de Kappa se obtuvo una concordancia muy buena (0,89), con p<0,05. Las lesiones sospechosas de células neoplásicas fueron tomadas como PCN para el análisis estadístico debido a que las lesiones SCN deben ser manejadas como PCN si no se cuenta con un diagnóstico concluyente. Al analizar el valor diagnóstico de la prueba se concluyó que este fue alto, con valores predictivos positivos de 0,95 y valor predictivo negativo de 0,93.
Al aplicar la prueba de correlación de Pearson se constató que existió una correlación significativa al nivel 0,01 (bilateral) entre la presencia de células neoplásicas detectadas a través de la citología y la biopsia (Tabla 5). Estos resultados concuerdan con los de un estudio similar realizado en el Hospital
Provincial Docente “Manuel Ascunce Domenech”, de la Provincia de Camagüey, en el que la citología demostró poseer 100% de sensibilidad, 28% de especificidad, valor predictivo y negativo de 91% y 100%, respectivamente, y 96% de eficiencia global de la prueba.(6)
En el caso de la lesión categorizada como PCN, a través de hitopatología, que resultó NCN a través de la citología, se trató de un carcinoma verrucoso de Ackerman, el que se presenta clínicamente como una lesión superficial de la mucosa bucal de crecimiento exofítico papilomatoso, la mayoría de las veces de color blanco, aunque también puede ser rosado, de evolución lenta y poco agresiva. Se muestra como una lesión de aspecto de coliflor, con profundas fisuras entre las proliferaciones exofíticas que siempre están contaminadas con Cándida albicans y raramente se ulcera.
Este tipo de carcinoma se caracteriza por desarrollar una superficie queratinizada, mientras que las células con características de malignidad se encuentran en la base de la lesión. Esta peculiaridad favorece el barrido de las células superficiales y enmascara la verdadera identidad de la lesión. La histología muestra la proliferación epitelial exofítica papilomatosa y endofítica, esta última sin carácter invasivo y que se dispone en masas bulbosas; mientras que las células individualmente no presentan atipias. Se pueden observar abscesos intraepiteliales e infección candidiásica superficial.(13)
La elevada concordancia del resultado citológico respecto al histopatológico en cuanto a la detección de células neoplásicas muestra el alto valor diagnóstico de la prueba. Si a lo anterior se añade la inmediatez del resultado (24 horas) se puede plantear que la citología devendría un medio fiable para el manejo del paciente con enfermedades premalignas y malignas de la cavidad bucal, a través del que se podría dilucidar, en un corto plazo de tiempo, la presencia de células neoplásicas. El rápido diagnóstico de las lesiones malignas de la cavidad bucal favorece la planificación quirúrgica oportuna y evita la progresión de la lesión en el tiempo de espera por el resultado histopatológico.(12)
En cuanto a la correspondencia entre el grado de diferenciación de la lesión, en el caso de las lesiones malignas, detectado a través de la citología y la biopsia (Tabla 6), once lesiones fueron clasificadas como bien diferenciadas tanto por el método histopatológico como por el citológico, para un 68,7% del total. Hubo cuatro lesiones clasificadas como bien diferenciadas a través de la citología que no coincidieron con el resultado histopatológico, tres moderadamente diferenciado y uno poco diferenciado. Al aplicar el coeficiente de correlación de Pearson (Tabla 7) no se obtiene una correlación significativa entre el resultado histológico y el citológico para el grado de diferenciación en los tumores malignos. La concordancia entre ambos métodos en cuanto a diferenciación de la lesión fue leve (0,094) según el índice Kappa, con p>0,282. La citología resultó ser útil en el diagnóstico genérico de la lesión, pero no así en la determinación del grado de diferenciación celular. En el mencionado estudio realizado en el Hospital “Manuel Ascunce Domenech” la citología demostró poseer 100% de sensibilidad y solo un 28% de especificidad.(6)
En relación a la correspondencia entre los diagnósticos histológico y citológico la coincidencia es en el 63,6% de los casos.
La correlación entre los resultados citológicos y los histológicos varían significativamente de un autor a otro y según el tipo de enfermedad a diagnosticar. Se destaca también la significación de la habilidad y la experiencia del Especialista en la certeza diagnóstica del método.(2,6)
En un estudio realizado en Valencia, Venezuela, en mayo de 2016, se asevera que los frotis citológicos tienen una alta capacidad de eficiencia para proporcionar información sobre lesiones malignas porque son alteraciones celulares con cambios muy marcados, superior a las encontradas en las lesiones premalignas.(14)
En los casos en los que no hubo correspondencia entre diagnósticos citológicos e histopatológicos, como se muestra en la Tabla 8, de un total de 11 lesiones, 10 eran benignas, para un 90,9%. Entre ellas se presentaron seis leucoqueratosis, dos líquenes planos, una neoplasia intraepitelial Grado I y una lesión por posible virus del papiloma humano.
El liquen plano bucal se caracteriza por ser una lesión con una intensa degeneración hidrópica vacuolar del citoplasma de las células basales que forma ampollas subepiteliales, conocidas como espacios de Max Joseph, un denso infiltrado inflamatorio celular difuso linfocitario en banda en contacto con la capa basal y la desaparición por sectores de la membrana basal Pas+. Está compuesto principalmente por linfocitos T (sobre todo CD4) y macrófagos. Aparecen también células de Langerhans, que se comportan como células presentadoras de antígenos para los linfocitos, que inducen lisis celular. Se demuestra la presencia de cuerpos hialinos esferoidales (cuerpos de Civatte), homogéneos y Pas+ como consecuencia de la necrosis prematura de queratinocitos basales; además en el epitelio aparecen hiperqueratosis y acantosis.(15)
Las mencionadas particularidades del liquen plano hacen que su diagnóstico definitivo sea histopatológico y no citológico debido a que se manifiestan cambios inflamatorios a nivel tisular, que son indicativos para el diagnóstico más que los cambios celulares vistos de manera aislada.(13)
La leucoqueratosis se caracteriza por ser una lesión blanca, blanda, de contornos suaves y límites poco precisos. La lesión puede desaparecer si se retiran los estímulos causales o puede evolucionar hacia los distintos grados hasta la malignización. Se caracteriza microscópicamente por la presencia de hiperqueratosis, que puede ser marcada, y suelen encontrarse discreta paraqueratosis y acantosis; por lo común la dermis está libre de infiltrado inflamatorio.(13)
En función del grado de la leucoqueratosis puede haber cambios que pueden ser más o menos evidentes a través de la citología. Los autores concuerdan con la literatura médica consultada, que destaca que la citología exfoliativa puede ser un importante auxiliar en los carcinomas bucales incipientes que tienen superficies ulceradas, mientras que las lesiones secas, costrosas, muy queratósicas o necrosadas, producen muestras malas y no se prestan para el examen citológico.(6)
Las lesiones en las que no se obtuvo coincidencia entre el diagnóstico citológico e histopatológico eran de forma plana en el 83,3% de los casos, con diámetro de 2 a 4cm y localizadas, mayormente, en la región del carrillo. Al analizar estas características macroscópicas de las lesiones los autores consideran que la forma plana, presente en las lesiones previamente discutidas (leucoqueratosis y liquen plano), no favorecen el desprendimiento celular tanto como las lesiones exofíticas y vegetantes, de manera que se obtiene un menor número de células para analizar, a pesar de encontrarse estas lesiones un sitio anatómico de fácil acceso como es el carrillo.
CONCLUSIONES
En el presente estudio se determinó la utilidad de la citología exfoliativa en el diagnóstico de las lesiones premalignas y malignas de la cavidad oral. La toma de muestra citológica con cepillo dental resultó ser un método poco cruento para los pacientes, sin tendencia a ocasionar dolor. Existió una correspondencia significativa entre la presencia de células neoplásicas detectadas a través de la citología y la biopsia, con un alto valor diagnóstico de la prueba determinado por el valor predictivo positivo y valor predictivo negativo. En cuanto al grado de diferenciación, en los tumores malignos, la citología exhibió una alta correspondencia del diagnóstico genérico, pero baja para el grado de diferenciación celular. El diagnóstico citológico coincidió con el histológico de manera predominante, es menos expedito el resultado en lesiones premalignas y planas.
REFERENCIAS BIBLIOGRÁFICAS
1. Escalona Veloz R. Diagnóstico histopatológico de cáncer bucal en el Hospital General Docente “Dr. Juan Bruno Zayas Alfonso”. MEDISAN [Internet]. 2015 Feb [citado 20/10/2018];19(2):223-228. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192015000200011
2. Acha A, Ruesga MT, Rodríguez MJ, Martínez de Pancorbo MA, Aguirre JM. Aplicaciones de la citologia oral por raspado (exfoliativa) en el cáncer y precáncer oral. Med Oral Patol Oral Cir Bucal [Internet]. 2005 Mar-Apr [citado 20/10/2018];10(2):95-102. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1698-44472005000200001
3. Herrera YA, Piña Sánchez P. Historia de la evolución de las pruebas de tamizaje en el cáncer cervicouterino. Rev Med Inst Mex Seguro Soc [Internet]. 2015 [citado 20/10/2018];53(6):670-7. Disponible en: http://revistamedica.imss.gob.mx/editorial/index.php/revista_medica/rt/printerFriendly/96/233
4. Diniz Freitas M, García García A, Crespo Abelleira A, Martins Carneiro JL, Gándara Rey JM. Aplicaciones de la citología exfoliativa en el diagnóstico del cáncer oral. Med Oral Patol Oral Cir Bucal (Ed.impr.) [Internet]. 2004 Oct [citado 20/10/2018];9(4):355-361. Disponible en: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1698-44472004000400014
5. Ceccotti EL, Sforza RR, Carzoglio JC, Luberti R, Flichman JC. El Diagnóstico en Clínica Estomatológica. 1ra ed. Buenos Aires: Editorial Médica Panamericana; 2007.
6. García-Roco Pérez O, Arredondo López M, Álvarez Navarro MC. Citología exfoliativa en el diagnóstico precoz de lesiones oncológicas bucales. Rev Cubana Estomatol [Internet]. 2002 May-Ago [citado 20/10/2018];39(2):89-100. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75072002000200002
7. Estrada Pereira GA, Márquez Filiu M, González Heredia E, Nápoles Pruna MM, Ramón Jiménez R. Infección por virus del papiloma humano en la cavidad bucal. MEDISAN [Internet]. 2015 Mar [citado 20/10/2018];19(3):300-306. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192015000300002
8. Rodríguez Guerrero K, Clavería Clark RA, Peña Sisto M. Consideraciones actuales sobre envejecimiento y cáncer bucal. MEDISAN [Internet]. 2016 Dic [citado 20/10/2018];20(12):25-6. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192016001200
9. Diéguez Pérez AR, Correa Rodríguez R, Fonseca del Rey S, Diéguez Pérez LB, Sardiña Hernández Y, Cedeño Gomez Y. Caracterización del cáncer bucal en la Isla de Juventud. 2007 – 2018. Rev Med Isla Juventud [Internet]. 2019 [citado 03/03/2021];20(1):[aprox. 15 p.]. Disponible en: http://www.remij.sld.cu/index.php/remij/article/view/216/420
10. Elzaurdín Mora RA, Lara Fernández N. Tratamiento combinado en cáncer de lengua. Rev Cubana Otorrinolaringol Cirug Cabeza Cuello [Internet]. 2021 [citado 03/03/2021];5(1):e181. Disponible en: http://www.revotorrino.sld.cu/index.php/otl/article/view/181/350
11. Rodríguez Martín O, Betancourt Valladares M, García Ranero AB, Giance Paz L. Pronóstico de incidencia y mortalidad del cáncer bucal en la provincia Ciego de Ávila. Rev Cubana Estomatol [Internet]. 2017 Jul-Sep [citado 20/10/2018];54(3):[aprox. 11 p.]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75072017000300005
12. González Y, Nieves Y, Quintero A. La Citología como un método preventivo de infecciones precursoras de lesiones de la cavidad oral [tesis]. Bárbula: Universidad de Carabobo; 2016 [citado 20/10/2018]. Disponible en: http://mriuc.bc.uc.edu.ve/bitstream/handle/123456789/5849/yugonzalez.pdf
13. Santana Garay JC. Atlas de patología del complejo bucal. 2da ed. La Habana: Editorial Ciencias Médicas; 2010.
14. Fuentes Y, Guzmán A, Monsalve L, Palencia D. Utilidad de la citología oral como método diagnóstico del virus del papiloma humano [tesis]. Valencia: Universidad de Carabobo; 2016 [citado 20/10/2018]. Disponible en: http://mriuc.bc.uc.edu.ve/bitstream/handle/123456789/6260/yufuentes.pdf
15. Pereda Rojas ME, González Cardona Y, Torres Herrera LW. Actualización sobre liquen plano bucal. CCM [Internet]. 2016 Jul-Sep [citado 20/10/2018];20(3):539-51.Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1560-43812016000300009
CONFLICTO DE INTERESES
Los autores declaran no tener conflicto de intereses.
CONTRIBUCIÓN DE LOS AUTORES
LBS: Conceptualización, curación de datos, análisis formal, investigación, metodología, administración del proyecto, validación, redacción del borrador original, redacción del borrador original, visualización.
MCP: Análisis formal, supervición, redacción (revisión y edición).
DAM: Investigación, visualización.
RRJ: Análisis formal, metodología, redacción (revisión y edición).
DDM: Redacción (revisión y edición), visualización.
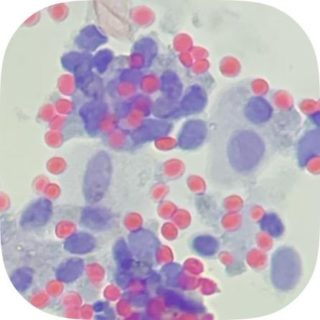
Fig. 1.1 Imagen Citológica |
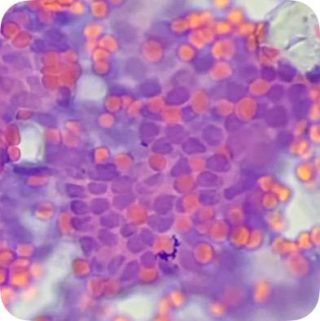
Fig. 1.2 Imagen Citológica |

Fig. 1.3 Imagen Citobloque |
| Paciente femenina de 54 años, histerectomizada hace 9 años por Ca In Situ Extenso. Diagnóstico de citología anterior hace 1 año: ASC-US vaginal. Colposcopía actual: Hipoestrogenismo. Diagnóstico de citología líquida actual y citobloque: ASC-H vaginal.Datos clínicos suministrados por el Dr. Enrique Marchena, Ginecólogo. Diagnóstico citológico, técnico Felipe Barquero. Diagnóstico cito-histo patológico, Dr. Erick Castro, Patólogo. Preservante celular, MC PapTest.
Figura 1.1 Tinción Papanicolaou. Citología. Se observan núcleos aumentados de tamaño. Relación núcleo:citoplasma aumentado. Hipercromasia. Células anormales dispuestas en grupo. Eritrocitos. Figura 1.2 Tinción Papanicolaou. Citología que muestra irregularidad nuclear prominente. Eritrocitos.
|
Figura 1.3 Tinción Hematoxilina – Eosina (HE). Bloque Celular. Relación núcleo:citoplasma aumentado. Hipercromasia. Grupo de células con cambios de atipia compatibles con al menos displasia leve.
DIAGNÓSTICO FINAL: ASC-H. ASC-H significa células escamosas atípicas, no se puede descartar lesión intraepitelial escamosa de alto grado (HSIL). La ASC-H se considera un resultado preliminar y no un diagnóstico final porque algunas afecciones no cancerosas pueden mostrar cambios similares. Estas condiciones incluyen atrofia de las células escamosas en mujeres posmenopáusicas, metaplasia de células escamosas, e inflamación. Las células endometriales normales también pueden confundirse con células escamosas de aspecto anormal.
|
Corporación DIMOPAT SRL, I&D Susan Vega, 2022
[vc_row][vc_column][vc_column_text]
Artículo de revisión Patología 2018 oct;56(4):233-37
Oralia Barboza-Quintana
Resumen
El sistema Bethesda para reporte de la citología ginecológica y anal ha tenido cambios importantes desde su inicio en 1988 hasta su última revisión en 2014. El objetivo principal de este sistema de reporte es que sea reproducible en los laboratorios de citología del mundo, lo que ha logrado con creces, por ser práctico, conciso y, sobre todo, por tomar en cuenta la biología de la lesión. El sistema Bethesda ha servido de modelo para otros reportes citológicos e histológicos en otros órganos: tiroides o líquidos, como la orina, entre otros. Sobresale la importancia de las pruebas de inmunohistoquímica y biología molecular del VPH y su utilidad para establecer las guías internacionales de la forma en que deben tratarse las pacientes que acuden a control citológico.
PALABRAS CLAVE: Reporte citológico; sistema Bethesda.
Jefa del servicio de Anatomía patológica y Citopatología, Hospital Universitario Dr. José Eleuterio González, Universidad Autónoma de Nuevo León.
Recibido: 10 de octubre 2018
Aceptado: 10 de diciembre 2018
Correspondencia
Oralia Barboza Quintana
oralibarboza@gmail.com
Este artículo debe citarse como
Barboza-Quintana O. Una revisión al sistema Bethesda 2014 para el reporte de citología ginecológica. Patología Rev Latinoam. 2018;56(4):233-37.
ANTECEDENTES
El sistema Bethesda para el reporte de la citología ginecológica nació en 1987 con el propósito de lograr estandarizar el reporte en los diferentes laboratorios de citología, como resultado de las críticas acerca de las practicas poco precisas y de bajo control de calidad en los laboratorios, lo que quedó evidenciado en una serie de artículos que aparecieron en el Wall Street Journal, Lax laboratories: the Pap test misses much cervical cancer through labs errors, por Walt Bogdanich.1
En 1988 se reunieron expertos y sociedades afines a la citopatología para elaborar el primer sistema Bethesda, liderados por Solomon.2 Los objetivos de esa reunión fueron crear un reporte citológico que fuera: clínicamente relevante, reproducible y flexible, que incluyera la biología de la lesión, calidad de la muestra y la atipia citológica. En 1991 se efectuó la primera revisión y surgió una mejor definición del formato y terminología del informe, y el desarrollo de criterios precisos y claros (“Libro azul”, 1994).3 En 2001 se llevó a cabo el tercer taller del sistema.
Patología Revista latinoamericana
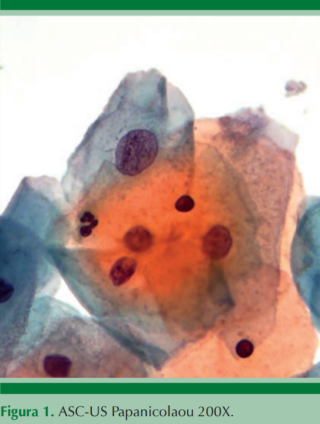
Bethesda para considerar los cambios de práctica clínica y los avances en ciencia y tecnología. Ahí se recomendaron los términos: “interpretación” o “resultado” en lugar de “diagnóstico” y los reportes de otras pruebas de laboratorio, como la biopsia cervical y el estado del VPH. La atipia se divide de células escamosas en ASC-US (Figuras 1 y 2) por el contexto clínico y de tratamiento que implica.4 Se incluye al adenocarcinoma in situ y en la atipia de células glandulares se trata de especificar su origen, cuando es posible.5
En la categoría de adecuado, ahora se considera que un espécimen puede ser adecuado para diagnóstico, aunque no contenga elementos de la zona de trasformación, pero si estos se observan deben incluirse en el reporte;6 lo mismo que la existencia de células endometriales en mujeres mayores de 45 años. En este último punto en la bibliografía existe evidencia que el
riesgo de una verdadera patología endometrial se incrementa cuando en mujeres mayores de 50 años se detectan células endometriales asociadascon sangrado.7,8
El reporte de los procesos reactivo e inflamatorio sigue igual, por lo que nos enfocaremos más en las anormalidades epiteliales. En el Cuadro 1 se muestra cómo deben reportarse hoy día las anormalidades de células escamosas.
ASC-US: permanecen los mismos criterios aun que debe tomarse en cuenta que la prevalencia de estos cambios declina con la edad, al igual que el VPH; por esto el ASC-US es más prevalente en mujeres jóvenes. Cuando se interpreten estas laminillas debe tomarse en cuenta el estatus del VPH, lo que en el presente y futuro será más frecuente porque el citotecnólogo y el patólogo tendrán conocimiento de si es VPH positiva, o no, antes de interpretar estos casos.9
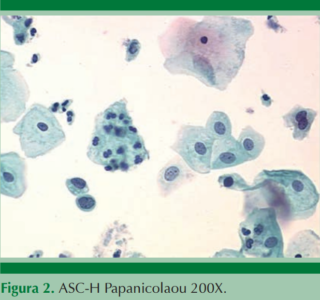
Cuadro 1. Células escamosas atípicas
ASC-US ASC-H Lesión intraepitelial de bajo grado (VPH, displasia leve/NIC1) Lesión intraepitelial de alto grado (displasia moderada y severa/ NIC2-3) Lesión intraepitelial de alto grado, con sospecha de invasión al estroma Carcinoma escamoso
ASC-H: estos casos representan menos de 10% de los casos de ASC, por lo que es un diagnóstico muy poco frecuente en los laboratorios de citología y se observan como células más pequeñas, con núcleo 2 a 3 veces el tamaño del núcleo del neutrófilo. Figura 3
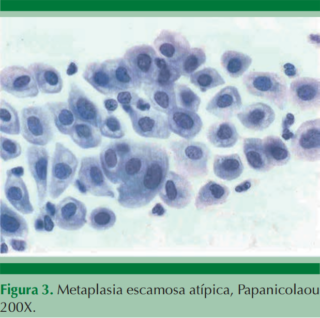
El diagnóstico diferencial es con metaplasia atípica inmadura, sábanas de células sobrepuestas, en la atrofia severa y en las pacientes posradiadas. La repercusión en el tratamiento es importante porque las pacientes con ASC más virus del papiloma humano positivo tienen 18% de riesgo de tener una lesión de alto grado contra ASC-H más VPH positivo, con riesgo de 45%;10 por eso estas pacientes van directo a colposcopia.
El resto de las lesiones epiteliales, de bajo y alto grado, sospecha de invasión y carcinoma escamoso invasor no han sufrido alteración en los criterios. Cuadro 2
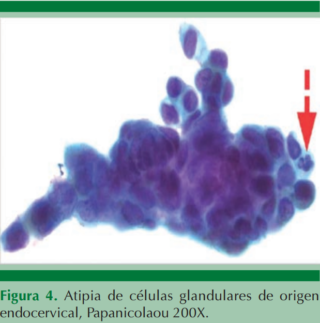
Cuadro 2. Células glandulares atípicas
Endocervicales atípicas (no especificado) Endometriales atípicas (no especificado) Glandulares atípicas (no especificado) Endocervicales atípicas (no especificado) Glandulares Adenocarcinoma endocervical in situ Adenocarcinoma Endocervical, endometrial, extrauterino, no especificado
En el caso de las lesiones atípicas glandulares se trata de establecer el origen endocervical (Figura 4) o endometrial (Figura 5) cuando es posible; además de especificar si son a favor de proceso neoplásico (Figura 6).
Existen diferentes estudios acerca de la importancia del diagnóstico de atipia de células glandulares y su relación con el VPH. Cuando una paciente tiene el diagnóstico de atipia de células glandulares más VPH positivo, la posibilidad de tener una lesión relevante es cercana a 5%, sobre todo de tipo escamoso cuando son menores de 30 años y de tipo endometrial en las mayores de 50 años.11,12
El resto de las lesiones glandulares permanece igual, con los mismo criterios y mismas categorías diagnósticas.


Si se practican estudios auxiliares diagnósticos, como las pruebas de detección de VPH o inmunohistoquímica y biomarcadores, el reporte debe comunicarse.
CONCLUSIONES
El sistema Bethesda ha tenido aceptación universal porque se basa en la evidencia, inclusión y consenso, está estrechamente relacionado con la biología de la lesión, es práctico y conciso,
fomenta la difusión del conocimiento mediante la publicación de atlas, páginas Web, etc. Ha
servido de modelo para otros reportes citológicos e histológicos en otros órganos: tiroides, orina,
glándulas salivales, páncreas y vías biliares. Es, además, de asuma importancia que el sistema Bethesda haya sido tomado en cuenta para establecer las guías internacionales de atención de pacientes que acuden a control citológico.13,14
REFERENCIAS
1. Bogdanich W. Lax laboratories: The Pap test misses much cervical cancer through labs’ errors. Wall Street Journal. November2, 1987:1
2. Solomon D, et al: The 1988 Bethesda System. or reporting cervical/vaginal cytologic diagnoses. Developed and approved at the National Cancer Institute Workshop, Bethesda, Maryland, USA, December 12–13, 1988. Acta Cytol 1989;33: 567-57.
3. Kurman RJ, Solomon D (eds): The Bethesda System for Reporting Cervical/Vaginal Cytologic Diagnoses. Definitions, Criteria, and Explanatory Notes for Terminology and Specimen Adequacy. New York, Springer, 1994.
4. Stoler MH, Schiffman M: Interobserver variability of cervical cytologic and histologic interpretations: realistic estimates from the ASCUS-LSIL triage study. JAMA 2001; 285:1500-5.
5. Wright TC, Cox JT, Massad LS, Twiggs LB Wilkinson EJ: 2001 Consensus guidelines for the management of women with cervical cytological abnormalities. JAMA 2002; 287:2120-29.
6. Sultana F (1) High-grade cervical abnormalities and cervical cancer in women following a negative Pap smear with and without an endocervical component: a cohort study with 10 years of follow-up.
7. Int J Cancer. 2014; 135:1213-9.
8. Shanna M. Colletti, Significance of finding benign endometrial cells in women 40–45 versus 46 years or older on Papanicolaou tests and histologic follow-up. Cytojournal. 2017; 14: 22.
9. Weiss VL. Age cut-off for reporting endometrial cells on a Papanicolaou test: 50 years may be more appropriate than 45 years. Cytopathology. 2016; 27:242-8.
10. Cormier K. NILM Pap slides from women 30 years of age and older with positive high-risk HPV DNA. Focused rescreening prior to report issuance, an enhanced quality control measure. Am J Clin Pathol. 2014; 14:494-500.
11. Schiffman M. Cervical-Cancer Screening with HumanPapillomavirus and Cytologic Cotesting. N Engl J Med 2013; 369:2324-31.
12. Tadahiro S. Clinical Significance of Atypical Glandular Cells in the Bethesda System 2001: A Comparison with the Histopathological Diagnosis of Surgically Resected Specimens. Cancer Investigation. 2014; 32:105–109.
13. Pradhan D. Clinical significance of atypical glandular cells in Pap tests: An analysis of more than 3000 cases at a large academic women’s center. Cancer Cytopathol. 2016; 124:589-95.
14. Nayar R. The Pap test and Bethesda 2014. Cancer Cytopathol 2015; 123: 271–281.[/vc_column_text][/vc_column][/vc_row]

La Patología Molecular es un tipo de diagnóstico que a través de los métodos de PCR (Reacción en Cadena de la Polimerasa) en tiempo real se podrían utilizar por ejemplo, para la tipificación del VPH y de Microorganismos (enfermedades de transmisión sexual o ETS). Se utiliza como vehículo la citología en base líquida (Papanicolaou) o las biopsias y para las muestras gástricas a través de sangre, biopsia o citología bucal.
Para mayor información nos pueden escribir a nuestro WhatsApp Corporativo 6189-5372

Interactively procrastinate high-payoff content without backward-compatible data. Quickly cultivate optimal processes and tactical architectures.
Somos una empresa costarricense, que rescata una trayectoria de conocimiento y experiencia en áreas de diagnóstico citopatológico, e innova para hacer de este, una herramienta importante de uso en la comunidad médica y para el bienestar de la población, proporcionando más tiempo y calidad de vida.
Suscríbase para recibir artículos médicos.